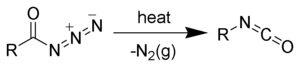Azoture d'acyle

Les azotures d'acyle sont des dérivés d'acide carboxylique de formule générale RCON3.
Synthèse[modifier | modifier le code]
Il est possible de synthétiser les azotures d'acyle à partir d'un chlorure d'acyle (à radical alkyle ou aryle) en le faisant réagir avec l'azoture de sodium en solution aqueuse[1],[2] :
Il est également possible de les synthétiser à partir de nombreux acides carboxyliques et de l'azoture de sodium, réactions catalysée par la présence de triphénylphosphine et de trichloroacétonitrile, avec de très bons rendements en conditions douces[3]. Une autre possibilité est de partir d'aldéhydes aliphatiques ou aromatiques et de les faire réagir avec l'azoture d'iode formée par réaction entre l'azoture de sodium et le chlorure d'iode dans l'acétonitrile[4].
Utilisations[modifier | modifier le code]
Les azotures d'acyle sont utilisés comme réactifs chimiques. Dans le réarrangement de Curtius, les azotures d'acyle sont convertis en isocyanates[5],[6],[7],[8]
Des azotures d'acyle sont aussi formés comme intermédiaires réactionnels dans la dégradation de Darapsky[9],[10],[11],[12],[13] qui transforme un α-cyanoester en acide aminé :
Notes et références[modifier | modifier le code]
- C. F. H. Allen and Alan Bell, Undecyl isocyanate, Org. Synth., coll. « vol. 3 », p. 846
- Jon Munch-Petersen, m-Nitrobenzazide, Org. Synth., coll. « vol. 4 », , p. 715
- (en) Doo Jang et Joong-Gon Kim, « Direct Synthesis of Acyl Azides from Carboxylic Acids by the Combination of Trichloroacetonitrile, Triphenylphosphine and Sodium Azide », Synlett, (DOI 10.1055/s-2008-1077979)
- (en) Lavinia Marinescu, Jacob Thinggaard, Ib B. Thomsen et Mikael Bols, « Radical Azidonation of Aldehydes », The Journal of Organic Chemistry, vol. 68, no 24, , p. 9453–5 (PMID 14629171, DOI 10.1021/jo035163v)
- (de) T. Curtius, « Titre manquant », Chemische Berichte, vol. 23, , p. 3023
- Th. Curtius, « 20. Hydrazide und Azide organischer Säuren I. Abhandlung », Journal für praktische Chemie, vol. 50, , p. 275 (DOI 10.1002/prac.18940500125)
- (en) P. A. S. Smith, « Titre manquant », Org. React., vol. 3, , p. 337–449
- Eric F. V. Scriven et Kenneth Turnbull, « Azides: Their preparation and synthetic uses », Chemical Reviews, vol. 88, no 2, , p. 297 (DOI 10.1021/cr00084a001)
- (en) A. Darapsky, « Darstellung von ?-Aminosäuren aus Alkyl-cyanessigsäuren », Journal für praktische Chemie, vol. 146, nos 8–12, , p. 250 (DOI 10.1002/prac.19361460806)
- (en) A. Darapsky et D. Hillers, « Über das Hydrazid der Cyanessigsäure, Isonitrosocyanessigsäure und Nitrocyanessigsäure », Journal für praktische Chemie, vol. 92, , p. 297 (DOI 10.1002/prac.19150920117)
- (en) P. E. Gagnon, P. A. Boivin et H. M. Craig, « Synthesis of Amino Acids from Substituted Cyanoacetic Esters », Can. J. Chem., vol. 29, , p. 70 (DOI 10.1139/v51-009)
- (en) E. H. Rodd, Chemistry of Carbon Compounds, New York, , 2e éd., p. 1157
- (en) Paul E. Gagnon, Guy Nadeau et Raymond Côté, « Synthesis of α-Amino Acids from Ethyl Cyanoacetate », Can. J. Chem., vol. 30, no 8, , p. 592 (DOI 10.1139/v52-071)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Acyl azide » (voir la liste des auteurs).